Terreno em preparo
Estudo de professor do ICB pode abrir caminho para cultivo em laboratório de células-tronco hematopoiéticas
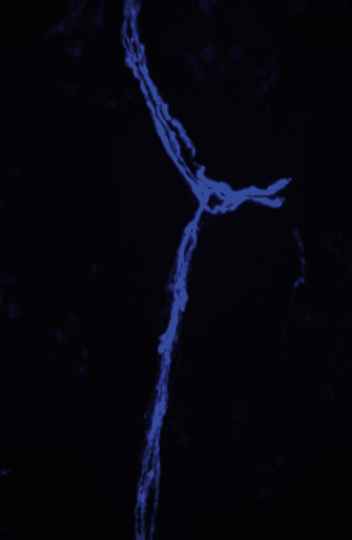
Realizado com o intuito de reconstituir os componentes do sangue de pacientes submetidos a processos agressivos como a quimioterapia, o transplante de medula óssea nem sempre alcança esse objetivo em sua plenitude, devido ao baixo número de células-tronco hematopoiéticas obtido nesse procedimento – apesar de seu enorme potencial, elas existem em quantidades reduzidas em cada organismo. No entanto, começam a ser desvendados os sinais químicos responsáveis pela reprodução dessas células-tronco – que originam todas as células do sangue –, o que abre caminho para seu cultivo em laboratório.
Essa descoberta foi descrita em artigo recém-publicado na revista Nature Cell Biology pelo professor Alexander Birbrair, do Departamento de Patologia do Instituto de Ciências Biológicas (ICB). Fruto de colaboração com pesquisadores de instituições dos Estados Unidos e do Japão, o trabalho identifica aspectos até então desconhecidos de microambientes dos ossos, onde se localizam dois tipos de células-tronco hematopoiéticas. Uma, mais potente, permanece “adormecida” na medula até o momento em que precisa formar células iguais a ela. A outra é acionada em casos de emergência para o organismo e se diferencia em vários tipos de células mais maduras, como macrófagos e linfócitos, capazes de eliminar micro-organismos e vírus. “Descobrimos basicamente a comunicação existente entre os microambientes vasculares e essas células na medula óssea”, comenta Birbrair.
O pesquisador explica que, diferentemente de outras células-tronco, as hematopoiéticas ainda não são obtidas eficientemente por multiplicação in vitro, já que, quando reproduzidas artificialmente, perdem a capacidade de formar todas as células sanguíneas. “Para criar esse ambiente artificial, precisamos compreender muito bem como funcionam no organismo vivo. Por isso, temos estudado os nichos onde elas se localizam, já que o osso é formado de várias estruturas e possui diferentes tipos de células”, diz.
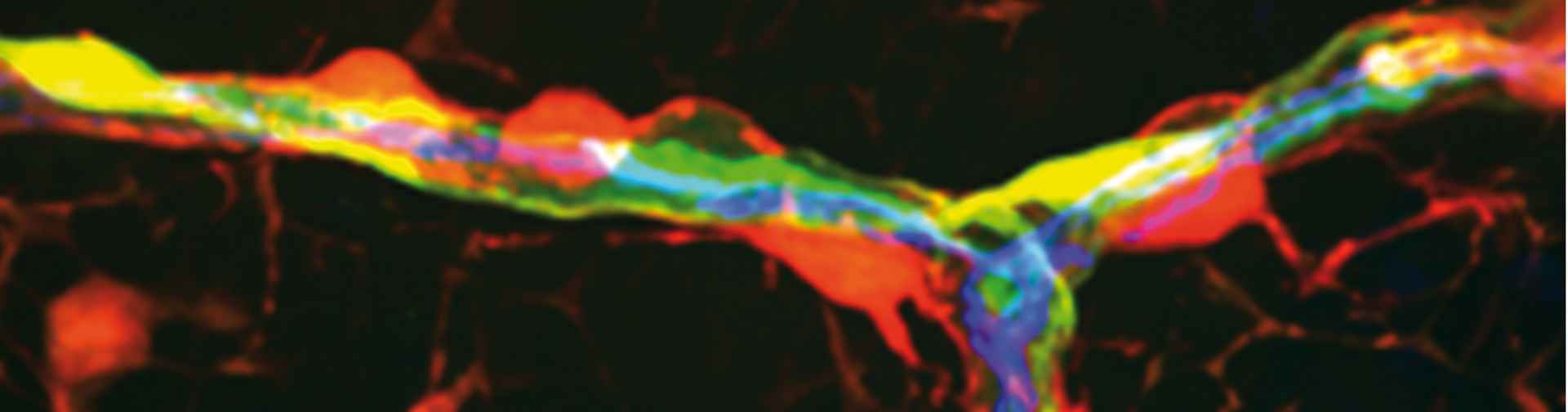
Entre as descobertas do trabalho está a presença, em locais específicos da estrutura óssea, de um tipo especial de célula, os pericitos. “As células se comunicam entre si por emissão de vários sinais químicos, como proteínas e citocinas. Observamos que os pericitos localizados nas arteríolas e nos sinusoides dos ossos se comunicam respectivamente com um dos tipos de células-tronco hematopoiéticas e enviam mensagens diferentes, levando a comportamentos distintos”, informa Birbrair. De acordo com o trabalho, as células-tronco hematopoiéticas dormentes ficam especificamente perto das arteríolas, e as outras, próximas aos sinusoides.
A equipe também descobriu que os pericitos localizados nos sinusoides sinalizam com a citocina Stem Cell Factor (SCF), enquanto aqueles alojados nas arteríolas se comunicam com a citocina CXCL12. “Investigamos se a citocina (ou sinal) CXCL12 é importante para a manutenção das células-tronco hematopoiéticas derivadas de todos os pericitos e vimos que não. Cada tipo de pericito é importante em seu microambiente vascular”, observa o pesquisador. Testes foram realizados com modelos de animais transgênicos, manipulados para evitar que os pericitos arteriolares produzissem a CXCL12. “Observamos que, quando removíamos essa citocina dos pericitos arteriolares, as células-tronco hematopoiéticas desapareciam. Trata-se, pois, de um sinal muito importante para mantê-las no estado de dormência nas arteríolas”, conclui.
Em lugares especiais
A origem de todas as células do sangue – leucócitos, hemácias, neutrófilos, entre outras – está nas células-tronco hematopoiéticas, que surgem no desenvolvimento do feto, a partir de células endoteliais, e raramente são formadas novamente na fase adulta. “O organismo as mantém protegidas em lugares muito especiais. No indivíduo adulto, a maior parte delas está na medula óssea, e algumas poucas, no baço”, explica Alexander Birbrair.
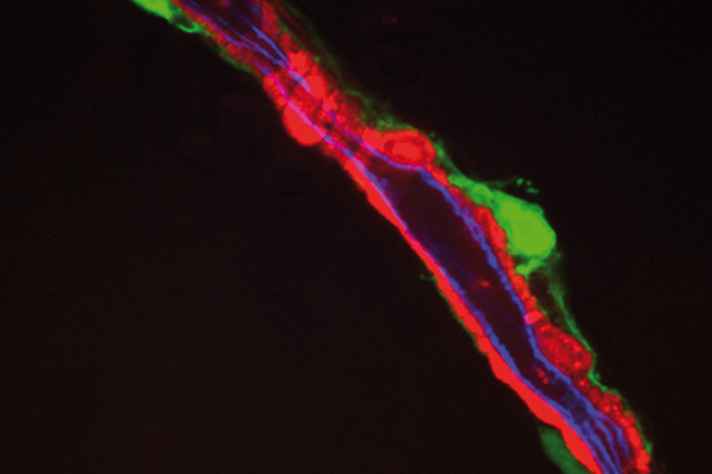
Ao se multiplicar, as células-tronco hematopoiéticas superpotentes geram células maduras, que têm pouco tempo de vida – toda hemácia dura apenas 120 dias no sangue – e forma apenas uma idêntica à original, chamada “superpotente”, que se mantém dormente ou adormecida. “O organismo sempre tenta manter uma reserva de células com esse potencial, mas essa regulação depende muito do microambiente. Dentro da medula óssea, é garantido que o processo vai ocorrer. O mesmo não se dá no pratinho de laboratório, por isso estamos estudando maneiras para mimetizar esse ambiente, com todas as sinalizações químicas, para vislumbrarmos a possibilidade de um cultivo artificial”, enfatiza Birbrair.
Segundo o pesquisador, do ponto de vista evolutivo, pode ser mais vantajosa a diferenciação em tipos de células com funções diversas, como proteção e oxigenação. Contudo, como nenhuma outra célula no organismo consegue dar origem às células-tronco hematopoiéticas, é fundamental que, no processo de proliferação, ocorra a formação de uma célula igual, que mantenha a característica de superpotência em uma reserva de células presentes no organismo, “uma vez que a diminuição dessas células leva à consequente diminuição de todas as outras células do sangue”, explica.
Bancos de células
A possibilidade de expandir as células-tronco hematopoiéticas em ambiente artificial pode levar à criação de bancos de células, o que facilitaria o tratamento de pacientes com leucemia, enfatiza Birbrair. “Apesar dos avanços na área, é difícil encontrar doador compatível, e a quantidade desse material é pequena. Algumas pessoas precisam de um segundo transplante de medula”, ressalta.
A possibilidade de expandir as células-tronco hematopoiéticas em ambiente artificial pode levar à criação de bancos de células, o que facilitaria o tratamento de pacientes com leucemia
Birbrair comenta que, se há 30 anos a leucemia não tinha tratamento, hoje há medicamentos que eliminam as células tumorais, mas também as células normais do organismo, as quais devem ser reconstituídas por meio de transplantes de células-tronco hematopoiéticas.
O procedimento consiste na infusão intravenosa dessas células, provenientes de um doador compatível, com o intuito de restabelecer a função medular e imune. “Esses transplantes, cujo número tem apresentado aumento expressivo, vêm sendo usados para a cura de diversas patologias, como doenças hematológicas malignas e não malignas, imunodeficiências, erros inatos do metabolismo e tumores sólidos”, explica.
Para que o enxerto das células-tronco hematopoiéticas de um doador – obtidas da medula óssea, de sangue periférico ou de cordão umbilical – tenha sucesso, é fundamental que as células infundidas proliferem e formem todas as células do sangue no receptor.

Artigo: Contribuição diferente de citocinas das células perivasculares para os nichos das células-tronco hematopoiéticas
Autores: Noboru Asada, Halley Pierce, Alexander Birbrair e Paul S. Frenette, vinculados ao Albert Einstein College of Medicine e ao Mount Sinai Center for Bioinformatics (EUA); Zichen Wang, Nicolas F. Fernandez e Avi Ma’ayan, vinculados ao Mount Sinai Center for Bioinformatics (EUA); Yuya Kunisaki, da Kyushu University (Japão)
Informações sobre outras pesquisas desenvolvidas no laboratório coordenado pelo professor Alexander Birbrair estão disponíveis no site www.icb.ufmg.br/birbrair.
